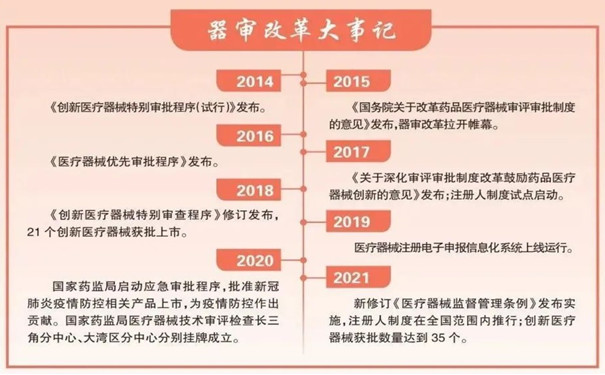
尽管新中国医疗器械有序监管之路起步相对较晚,但从第一个医疗器械监管法规制定之日起,领导层就高瞻远瞩、逐步为创新医疗器械注册审评建立秩序,铺平道路。自2014年2月,国家药监部门发布《创新医疗器械特别审批程序(试行)》,不断为创新医疗器械注册审评出台专项制度,有序推进医疗器械产业创新发展。仅2022年初至今,我国获批上市的创新医疗器械就达到44个,这一数字早已超过了2021年全年的数字。
尽管新中国医疗器械有序监管之路起步相对较晚,但从第一个医疗器械监管法规制定之日起,领导层就高瞻远瞩、逐步为创新医疗器械注册审评建立秩序,铺平道路。自2014年2月,国家药监部门发布《创新医疗器械特别审批程序(试行)》,不断为创新医疗器械注册审评出台专项制度,有序推进医疗器械产业创新发展。仅2022年初至今,我国获批上市的创新医疗器械就达到44个,这一数字早已超过了2021年全年的数字。
从仿制到创新发展之路,创新医疗器械注册审批之路越走越平坦:
在开辟特别审查“绿色通道”的同时,为进一步满足临床诊治需要,另一条快速通道也由此打开。2016年10月,国家药监部门发布《医疗器械优先审批程序》,对诊断或者治疗罕见病、恶性肿瘤、老年人特有和多发疾病、专用于儿童、临床急需等医疗器械予以优先审批。一旦确定某项目予以优先审批,国家药监部门将全环节发力加快审评审批:优先进行技术审评,优先安排医疗器械注册质量管理体系核查,优先进行行政审批……截至2021年底,通过该程序获批上市的医疗器械达到49个。
此外,为有效预防、及时控制和消除突发公共卫生事件的危害,确保突发公共卫生事件应急所需医疗器械尽快完成审批,国家药监部门还开辟了医疗器械应急审批通道。
2020年初,面对突如其来的新冠肺炎疫情,国家药监局第一时间启动应急审批工作,仅用4天时间就批准了4个新冠病毒核酸检测产品上市,有力地支持了疫情防控初期工作。截至2021年底,全国共有68个新型冠状病毒检测试剂、12个配套仪器设备、5个血液净化设备及其配套耗材、6个体外心肺支持辅助设备及其配套耗材、10个呼吸机等产品相继通过应急审评审批上市。相关产品的应急上市,不仅为我国有效控制疫情提供了物资保障,还为全球抗疫提供了中国智慧和中国力量。中国医药保健品进出口商会统计显示,2021年我国防疫物资出口总值达200多亿美元,其中体外诊断产品出口额达130.93亿美元,同比增长157.37%。
2018年2月27日,上海远心医疗科技有限公司的单道心电记录仪获得了由原上海市食品药品监管局颁发的第二类医疗器械产品注册证,成为国内首个按医疗器械注册人制度试点获批上市的产品。医疗器械注册人制度打破了此前产品注册与生产许可“捆绑”的管理模式,可使注册人从生产厂房、设施设备的配置与维护中解脱出来。2017年12月,医疗器械注册人制度试点在上海自贸试验区启动。2019年,试点省份扩大到22个,注册人试点工作加速推进。
2021年6月1日,新修订《医疗器械监督管理条例》施行,标志着医疗器械注册人制度在全国范围内正式推行。