2023年12月19日,上海药品监督管理局公开了上海科赐医疗技术有限公司的第二类医疗器械产品注册(一次性使用食管牵开球囊导管)的注册审评报告。一起来关注这个有代表性产品的特点及审评情况。
2023年12月19日,上海药品监督管理局公开了上海科赐医疗技术有限公司的第二类医疗器械产品注册(一次性使用食管牵开球囊导管)的注册审评报告。一起来关注这个有代表性产品的特点及审评情况。

一、产品概述
(一)产品结构及组成SAFER-A480s、SAFER-A520s 由牵开球囊组件、鞘管套件、鞘管辅助器、三通阀、延长管、固定头带和石蜡棉球组成;石蜡棉球采用具有有效医疗器械注册产品。SAFER-B480、SAFER-B520 由牵开球囊组件、鞘管套件、鞘管辅助器、三通阀、延长管和石蜡棉球组成;石蜡棉球采用具有有效医疗器械注册产品。产品经环氧乙烷灭菌,一次性使用,货架有效期2 年。
(二)产品适用范围本产品适用于心脏消融手术过程中牵开食管。
(三)型号/规格一次性使用食管牵开球囊导管产品型号规格包括SAFER-A480s、SAFER-A520s、SAFER-B480、SAFER-B520。
(四)工作原理一次性使用食管牵开球囊导管产品采用可弯曲的偏心球囊结构,在心脏电生理介入消融手术的过程中,将弯曲球囊送入食管与心脏相邻的位置,在保证球囊弯曲度和刚性的条件下,以主动干预的方式,带动食管弯曲,从而远离心脏消融的位置,阻断消融温度传递到食管。
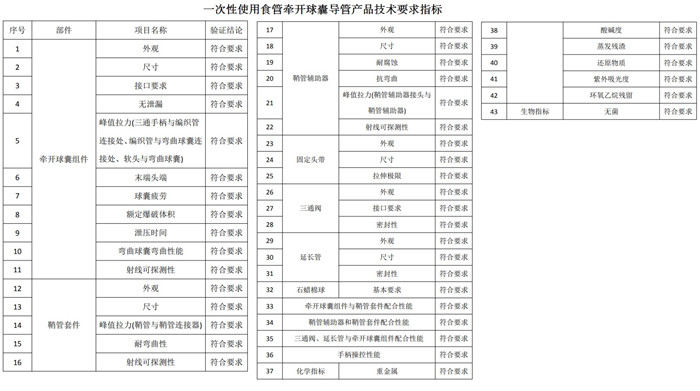
二、一次性使用食管牵开球囊导管注册产品技术要求
产品技术要求研究产品技术要求研究项目如下图所示:
三、生物相容性
一次性使用食管牵开球囊导管牵开球囊组件、鞘管套件、鞘管辅助器、三通阀、延长管、固定头带和石蜡棉球组成,其中弯曲球囊、鞘管套件、鞘管辅助器,与人体自然腔道(鼻腔和食管黏膜)接触;三通阀、延长管、固定头带,与人体皮肤接触。申请人按照 GB/T 16886 系列标准对所有部件分别进行了生物相容性评价,产品的生物相容性风险可接受
四、灭菌
该产品以无菌状态提供,采用环氧乙烷灭菌,申请人提供了灭菌确认报告,证明无菌保证水平为 10-6,环氧乙烷残留量不大于10μg/g。
五、产品有效期和包装
该产品货架有效期为 2 年。申请人提供了货架有效期验证报告,验证试验为加速老化验证,包括产品稳定性验证、包装完整性和模拟运输验证。
六、临床评价概述
该产品采用临床试验路径进行临床评价,采用前瞻性、多中心、单组目标值对照试验设计,以验证该产品的安全性及有效性。试验共入组 122 例受试者。主要有效性评价指标为:消融线与食管不重合率;次要有效性评价指标为:操作满意度;安全性评价指标为:食管机械性损伤、不良事件和严重不良事件。该临床试验共在 9 家临床机构开展,纳入统计全分析集(FAS)119 例,符合方案集(PPS)119 例。
临床试验结果显示:
(1)主要有效性评价指标使用试验产品进行食管牵移后,消融线与食管不重合率及其置信区间为95.8%(90.47%-98.62%),置信区间下限大于目标值80%,提示试验成功。
(2)次要有效性评价指标试验产品的操作满意度,评分为 5 分的占比85.7%,评分为4分的占比 13.4%,评分为 3 分的占比 0.8%,提示试验产品的操作可行性良好。
(3)安全性评价指标本研究试验期间未发生严重的器械相关不良事件、未发生导致退出的不良事件、未发生导致退出的器械相关不良事件。综上,临床评价资料符合目前临床审评要求。