一次性使用病毒采样管通常由拭子和/或含保存液的杯、管等组成。非无菌提供。用于样本的收集、运输和储存等。近期问到一次性使用病毒采样管备案?的客户较多,因此,写篇文章,为大家做个科普。
引言:一次性使用病毒采样管通常由拭子和/或含保存液的杯、管等组成。非无菌提供。用于样本的收集、运输和储存等。近期问到一次性使用病毒采样管备案的客户较多,因此,写篇文章,为大家做个科普。

一、一次性使用病毒采样管的分类:
在我国现行医疗器械分类目录内,一次性使用病毒采样管分类信息如下:
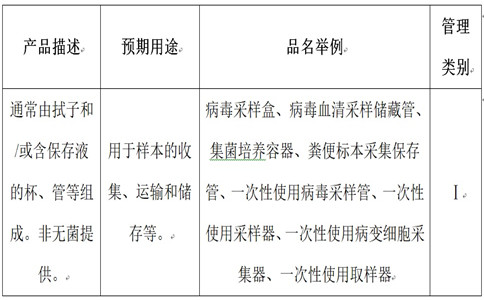
依据产品分类,病毒采样管备案事项应按照我国第一类医疗器械产品备案和第一类医疗器械生产备案流程办理相应备案。
二、一次性使用病毒采样管备案注意事项:
首先,从产品描述我们可以看到,一次性使用病毒采样管通常由由拭子和/或含保存液的杯、管等组成,从组成结构信息可以看到,单一的杯、管,不能称作是一次性使用病毒采样管。
其次,从医疗器械定义角度,我国对医疗器械的定义,强调独立的医疗功能和用途,比如,一次性使用病毒采样管应具有样本的收集、运输和储存功能,因此,单一的杯、管,多数情况作为医疗器械企业的配套原料之一,而不作为医疗器械管理。生产单一的杯、管企业,无需办理医疗器械备案资质。