引言:依据医疗器械分类目录,一次性使用静脉营养输液袋在我国属于第三类医疗器械注册产品,分类编码14-02-11,一起来学习一次性使用静脉营养输液袋注册流程和审查要点。
一、医疗器械注册单元划分
产品的注册单元划分原则上应符合《医疗器械注册单元划分指导原则》的要求,主要材质不同的静脉营养袋建议划分为不同的注册单元进行申报。
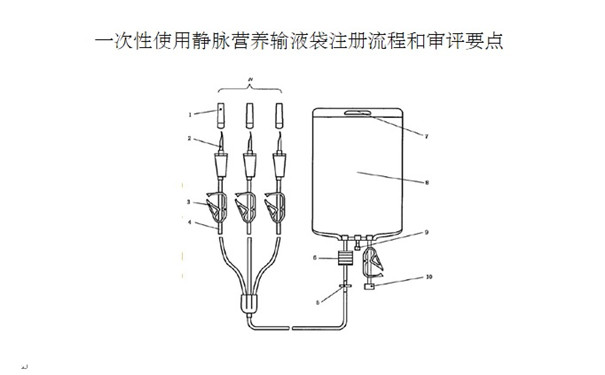
对于产品的型号规格划分,应说明产品的型号规格及划分依据,明确各型号规格的区别(如公称容量的不同,是否含进气器件、注射件、瓶塞穿刺器等),可列表对不同型号规格的结构组成加以描述,也可采用示意图进行表述。
二、一次性使用静脉营养输液袋产品技术要求
医疗器械注册申请人应结合产品的技术特征和临床使用情况来编制技术要求,对宣称的技术参数和功能,若适宜,应在产品技术要求中予以规定;产品技术要求中的内容引用国家标准、行业标准的应保证其适用性。
产品技术要求应包括但不局限于以下内容:
2.1产品型号规格及划分说明
应列明申报型号规格及其划分依据,明确各型号规格的区别,可列表对不同型号规格的结构组成加以描述。
2.2产品的基本信息
2.2.1产品各组件及对应原材料的列表;与人体直接或间接接触的组件需明确原材料牌号或符合的医用级国行标。
2.2.2产品结构示意图。
2.2.3产品灭菌方式、有效期等。
2.3性能要求及试验方法
2.3.1物理性能
应包含YY/T 0611《一次性使用静脉营养输液袋》适用的相关性能,申报产品的结构非YY/T 0611的设计结构,或在YY/T 0611给出的结构基础上还有其它设计元素的,应制订与之相关的性能要求,如进液管路上装配的药液过滤器等。
2.3.2化学性能
应包含YY/T 0611适用的化学要求。
2.3.3 其他
无菌、细菌内毒素。
产品性能指标和试验方法若不适用于YY/T 0611的相关要求,需具体阐述其理由及相应的科学依据。性能要求的试验方法采用注册申请人自行制定方法的,应在研究资料中补充方法学验证报告。
三、适用范围和禁忌证
3.1适用范围:用于医疗机构中,使用前充入营养液或药液,再与输液器和静脉内器械(如中心静脉导管)连接向体内输注。申报产品如含分离式输液管路,应注明申报产品是采用压力输注还是重力输注。
3.2禁忌证:说明该器械不适用的人群或情形。
四、一次性使用静脉营养输液袋注册流程
按照我国第三类医疗器械注册流程办理即可。
更多有关第三类医疗器械注册服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。