第二类体外诊断试剂变更注册常见发补问题
发布日期:2023-06-13 19:37浏览次数:719次
写有关医疗器械变更注册事项的文章比较多,以为体外诊断试剂相对常规器械更加稳定,较少写有关体外诊断试剂变更注册这个话题。本文带大家一起了解第二类体外诊断试剂变更注册常见发补问题。
写有关医疗器械变更注册事项的文章比较多,以为体外诊断试剂相对常规器械更加稳定,较少写有关体外诊断试剂变更注册这个话题。本文带大家一起了解第二类体外诊断试剂变更注册常见发补问题。
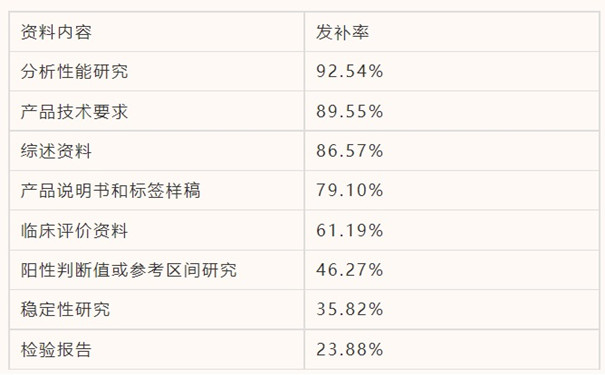
第二类体外诊断试剂变更注册常见发补问题:
体外诊断试剂变更注册最常见发补问题是对变更内容的验证和确认不够充分,或表述不规范。大部分问题与前文首次注册常见问题相同,不再赘述。另有一些注册变更时需特别注意的问题有:性能指标变更中,未提供变更指标在已获批适用机型上的验证资料;未提供多批性能验证资料。检验方法变更中,未提供相关验证资料;未说明变更方法的科学和理性。参考区间变更中,未对变更人群区间进行说明或验证。产品技术要求变更中,变更申请项目描述不规范;变更后的产品技术要求的性能指标和检验方法未体现符合国家标准品的要求。适用仪器变更中,未提供新增机型的注册证信息。除此之外,部分变更申报资料的风险分析报告中未对变更内容进行风险分析,不能从产品的预期用途和与安全性等方面,分析并识别变更的情况对于产品风险状态的影响;还有一些申报资料的变更内容未在关联项目(如技术要求和说明书)中进行同步修正。