按照马来西亚《医疗器械管理法》规定,所有在马来西亚生产、进口的医疗器械产品都必须在医疗器械管理局进行医疗器械注册后方可进入市场。对于进口的医疗器械生产商而言,需找到授权代理(authorized represetative,AR)完成注册事宜。马来西亚医疗器械监管的主管部门为卫生部下属的医疗器械管理局(Medical Device Athority,MDA)。
引言:按照马来西亚《医疗器械管理法》规定,所有在马来西亚生产、进口的医疗器械产品都必须在医疗器械管理局进行医疗器械注册后方可进入市场。对于进口的医疗器械生产商而言,需找到授权代理(authorized represetative,AR)完成注册事宜。马来西亚医疗器械监管的主管部门为卫生部下属的医疗器械管理局(Medical Device Athority,MDA)。

马来西亚医疗器械管理局主要职责范围是:责成医疗器械厂商(本国或外国)严格遵守《医疗器械质量管理体系》(ISO13485)的质量体系要求;指导厂商进行创新产品的临床试验;对本国及进口的医疗器械产品进行注册及疏通医疗器械国内销售渠道。
一、马拉西亚医疗器械分类:
在马来西亚,医疗器械是指制造商为诊断、预防、监测、治疗或减轻疾病或伤害而打算单独或组合用于人类的任何仪器、器械、工具、机器、器具、植入物、体外试剂或校准器、软件、材料或其他类似或相关物品。
马拉西亚医疗器械注册程序和准则严格遵循东盟医疗设备指令(AMDD)标准。器械被分为A、B、C、D四类,从低风险分类到高风险分类排序。此外,还有第五类为组合器械。注册途径根据设备的分类而有所不同。
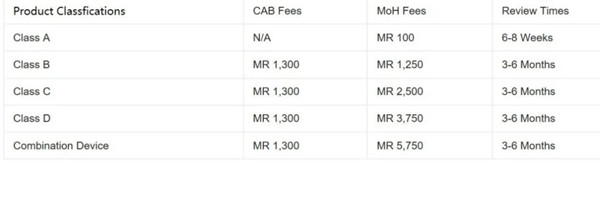
医疗器械注册申请必须通过在线MEDCAST系统提交,由获得许可的当地实体公司同时作为License Holder,或Malaysia Authorized Holder(MAH)。许可证可以从一个授权代表(Authorized Representative,简称AR)转移到另一个。新的AR将在卫生部MEDCAST在线门户网站上填写一份申请。所需文件包括现任AR申报表(Annex B – MDA/GD0041)、终止信和新AR的授权信。卫生部对每个医疗器械注册ID收取约500马币(115美元)。更多有关马拉西亚医疗器械注册服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。