2023年8月29日,为及时研究并解决GB 9706.1-2020及配套并列标准、专用标准实施的重大技术问题,更好地发挥技术支撑作用,国家药品监督管理局医疗器械标准管理中心根据《国家药品监督管理局关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》有关要求,制定并发布了《GB 9706.1-2020及配套并列标准、专用标准专家咨询机制》,详见正文。
2023年8月29日,为及时研究并解决GB 9706.1-2020及配套并列标准、专用标准实施的重大技术问题,更好地发挥技术支撑作用,国家药品监督管理局医疗器械标准管理中心根据《国家药品监督管理局关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》有关要求,制定并发布了《GB 9706.1-2020及配套并列标准、专用标准专家咨询机制》,详见正文。
GB 9706.1-2020及配套并列标准、专用标准专家咨询机制
为及时研究并解决GB 9706.1-2020 及配套并列标准、专用标准实施的重大技术问题,更好地发挥技术支撑作用,统一对标准的理解和认识,规范执行尺度,推进标准顺利实施,特制定本机制。
一、受理范围
GB 9706.1-2020及配套并列标准、专用标准实施过程中,药品监督管理部门、技术审查部门、医疗器械检验机构对标准内容理解存在差异等影响标准实施的重大技术问题。
二、专家组成员单位
牵头单位:中国食品药品检定研究院(国家药品监督管理局医疗器械标准管理中心)(以下简称器械标管中心)。
成员单位:中国食品药品检定研究院、国家药品监督管理局医疗器械技术审评中心、相关标准归口医疗器械标准化技术委员会。
根据咨询所涉标准情况,可增加有代表性产品的属地药品监督管理部门以及属地药品监督管理部门医疗器械技术审查部门、具有相关检验资质的医疗器械检验机构。
三、工作程序
(一)省级药品监督管理部门、技术审查部门、医疗器械检验机构之间若对标准内容理解存在差异等影响标准实施的重大技术问题且无法协调一致的可书面向器械标管中心提交咨询(提交内容和要求见附1)。
(二)器械标管中心根据咨询事项涉及的标准,组织标准归口的医疗器械标准化技术委员会开展研究。技术委员会应及时和提出单位进行充分沟通,原则上应在15个工作日内提出处理意见。若能形成一致意见,由技术委员会对相关问题予以书面解答,视情况发布相关解释性文件,并将相关情况报送器械标管中心;若不能达成一致,技术委员会提出处理意见、报器械标管中心研究,是否启动专家咨询。
(三)若启动专家咨询,器械标管中心将视情况组织咨询会议,由专家组成员单位根据咨询事项推荐1名专家代表本单位参加会议。
(四)会议由器械标管中心主持,如需要,器械标管中心可于会议开始前指定专家组组长。会议原则上协商一致,提出解决方案,形成专家会商意见。若不能达成一致,进行投票表决,超过半数的意见作为专家会商意见。.
(五)对影响标准全面实施的整体性、共性问题,器械标管中心在专家会商意见的基础上,组织起草解释性文件。国家标准的解释报送国务院标准化行政主管部门发布;行业标准的解释由国家药品监督管理局发布。
四、附则
(一)本机制由器械标管中心负贵解释。
(二)本机制自发布之日起实施。
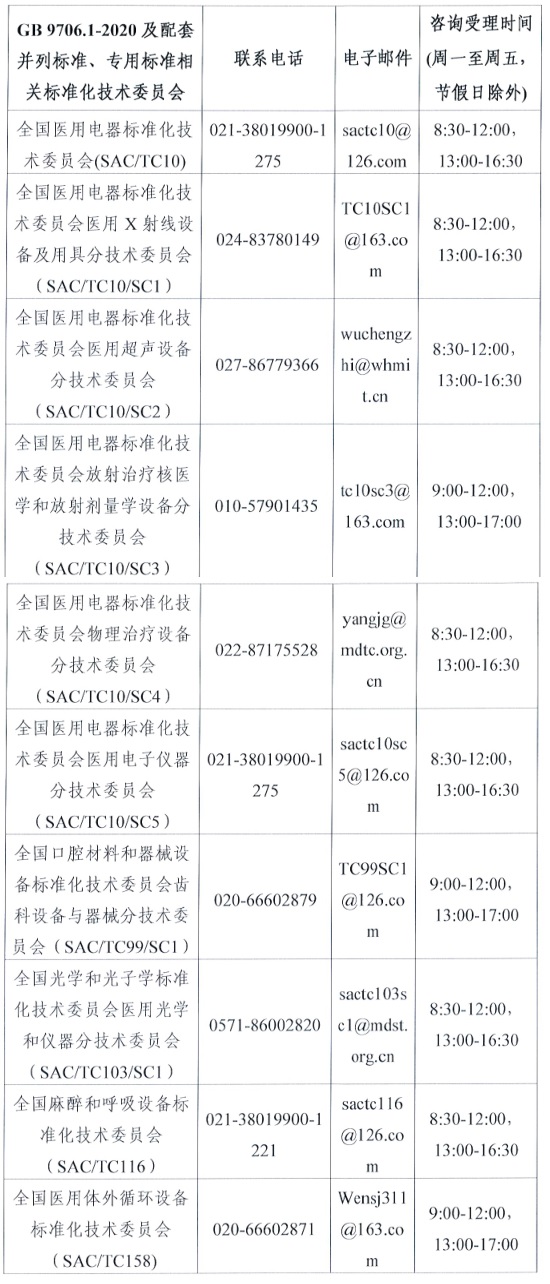
(三)关于GB 9706.1-2020 及配套并列标准、专用标准的具体技术问题,可电话咨询所涉标准归口的医疗器械标准化技术委员会,联系电话见附2。
附件1.GB9706.1-2020及配套并列标准、专用标准专家咨询事项信息表

附件2.GB9706.1-2020及配套并列标准、专用标准相关标准化技术委员会
更多有关GB9706.1-2020标准、可用性工程文档编制服务等需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。